In the early 20th century, experiments by Ernest Rutherford established that atoms consisted of a diffuse cloud of negatively charged electrons surrounding a small, dense, positively charged nucleus. Given this experimental data, Rutherford naturally considered a planetary-model atom, the Rutherford model of 1911 – electrons orbiting a solar nucleus – however, said planetary- model atom has a technical difficulty. The laws of classical mechanics (i.e. the Larmor formula), predict that the electron will release electromagnetic radiation while orbiting a nucleus. Because theelectron would lose energy, it would rapidly spiral inwards, collapsing into the nucleus on a timescale of around 16 picoseconds. This atom model is disastrous, because it predicts that all atoms are unstable.
Also, as the electron spirals inward, the emission would rapidly increase in frequency as the orbit got smaller and faster. This would produce a continuous smear, in frequency, of electromagnetic radiation. However, late 19th century experiments with electric discharges have shownthat atoms will only emit light (that is, electromagnetic radiation) at certain discrete frequencies.
To overcome this difficulty, Niels Bohr proposed, in 1913, what is now called the Bohr model of the atom. He suggested that electrons could only have certain classical motions:
1. Electrons in atoms orbit the nucleus.
2. The electrons can only orbit stably, without radiating, in certain orbits (called by Bohr the “stationary orbits”) at a certain discrete set of distances from the nucleus. These orbits are associated with definite energies and are also called energy shells or energy levels. In these orbits, theelectron’s acceleration does not result in radiation and energy loss as required by classical electromagnetics.
3. Electrons can only gain and lose energy by jumping from one allowed orbit to another, absorbing or emitting electromagnetic radiation with a frequency ν determined by the energy difference of the levels according to the Planck relation:
Where h is Planck’s constant. The frequency of the radiation emitted at an orbit of period T is as it would be in classical mechanics; it is the reciprocal of the classical orbit period:
The significance of the Bohr model is that the laws of classical mechanics apply to the motion of the electron about the nucleus only when restricted by a quantum rule. Although rule 3 is not completely well defined for small orbits, because the emission process involves two orbits with two different periods, Bohr could determine the energy spacing between levels using rule 3 and come to an exactly correct quantum rule: the angular momentum L is restricted to be an integer multiple of a fixed unit:
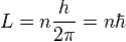
Where n = 1, 2, 3, is called the principal quantum number, and ħ = h/2π. The lowest value of n is 1; this gives a smallest possible orbital radius of 0.0529 nm known as the Bohr radius. Once an electron is in this lowest orbit, it can get no closer to the proton. Starting from the angular momentum quantum rule, Bohr was able to calculate the energies of the allowed orbits of the hydrogen atom and other hydrogen-like atoms and ions. Other points are:
1. Like Einstein’s theory of the Photoelectric effect, Bohr’s formula assumes that during a quantum jump a discrete amount of energy is radiated. However, unlike Einstein, Bohr stuck to the classical Maxwell theory of the electromagnetic field. Quantization of the electromagneticfield was explained by the discreteness of the atomic energy levels; Bohr did not believe in the existence of photons.
2. According to the Maxwell theory the frequency ν of classical radiation is equal to the rotation frequency νrot of the electron in its orbit, with harmonics at integer multiples of this frequency. This result is obtained from the Bohr model for jumps between energy levels En andEn−k when k is much smaller than n. These jumps reproduce the frequency of the k-th harmonic of orbit n. For sufficiently large values of n (so-called Rydberg states), the two orbits involved in the emission process have nearly the same rotation frequency, so that the classical orbitalfrequency is not ambiguous. But for small n (or large k), the radiation frequency has no unambiguous classical interpretation. This marks the birth of the correspondence principle, requiring quantum theory to agree with the classical theory only in the limit of large quantum numbers.
3. The Bohr-Kramers-Slater theory (BKS theory) is a failed attempt to extend the Bohr model which violates the conservation of energy and momentum in quantum jumps, with the conservation laws only holding on average. Bohr’s condition that the angular momentum is aninteger multiple of ħ was later reinterpreted in 1924 by de Broglie as a standing wave condition: the electron is described by a wave and a whole number of wavelengths must fit along the circumference of the electron’s orbit:
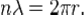
Substituting de Broglie’s wavelength of h/p reproduces Bohr’s rule. In 1913, however, Bohr justified his rule by appealing to the correspondence principle, without providing any sort of wave interpretation. In 1913, the wave behavior of matter particles such as the electron (i.e., matterwaves) was not suspected.

